Head of the working group

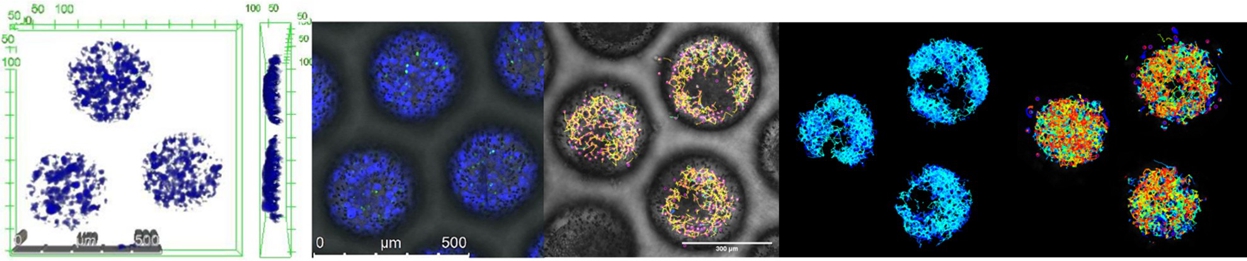
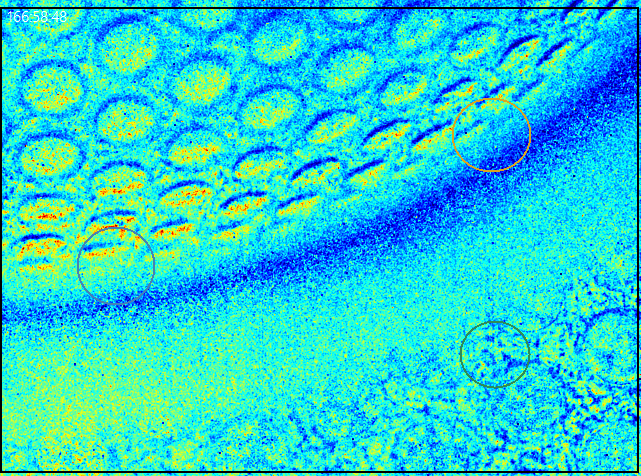
The group 3D-Cell Culture Systems is concerned with the development of oxygen-sensitive polymers for optical oxygen measurements in organoid cultures and the development of 3D culture models.

Research Topics

Project fundings

Staff

Job Offers

Publications
Lectures

Cenibra Young Scientist Imaging Jumpstarter Award

Complete article on LinkedIn

Frontiers in Bioengineering and Biotechnology, Section Biosensors and Biomolecular Electronincs.