Dr.-Ing. Raphael Greifenstein
- Postdoc
- Gruppe: Bioprozesstechnik und Biosysteme
- Raum: 238
- Tel.: 2-2986
- raphael greifenstein ∂does-not-exist.kit edu
Forschung
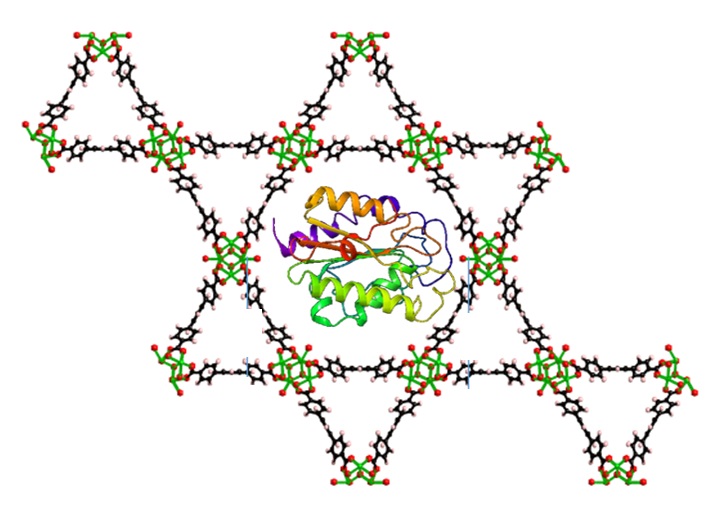
Enzyme@MOF – Forschung an Biokatalysatoren immobilisiert in metallorganischen Gerüstverbindungen
Durch die Immobilisierung von Enzymen auf festen Trägern können Reaktionsprozesse effektiver kontrolliert und die Enzymstabilität unter Lagerungs- und Betriebsbedingungen verbessert werden. Die immobilisierten Enzyme können wiederverwendet und müssen nicht Zeit und kostenintensiv von dem Produkt getrennt werden. Als Träger haben Metallorganische Gerüstverbindungen (englisch metal-organic frameworks, MOFs) ein großes Potential. MOF sind hochporöse Nanostrukturen mit streng definierter Kristallinität und großer spezifischer Oberfläche. Sie bieten eine enorme Vielfalt an möglichen Porenstrukturen und –geometrien sowie an gezielt beinflussbaren chemischen Eigenschaften des Materials. Durch die Immobilisierung von Enzymen in MOFs können Reaktionsprozesse effektiver kontrolliert und die Enzymstabilität unter Lagerungs- und Betriebsbedingungen verbessert werden. Dank der Vielzahl an Verbindungsmöglichkeiten von Metallknoten und Linkern besteht ein riesiges Potential an Kombinationen von Enzymen und MOF. Das Ziel des Projekts in diesem relativ neuen Forschungsbereich ist ein tieferes Verständnis der Mechanismen der Immobilisierung von Enzymen in MOFs sowie der Verteilungsgleichgewichte- und kinetischen Vorgänge während der biokatalytischen Reaktionen von Enzym@MOF- Immobilisaten. Hierdurch sollen die Einflussfaktoren und limitierenden Randbedingungen für die Immobilisierung sowie die anschließenden Reaktionen klar identifiziert und vor allem quantifiziert werden, um das Potential MOF-basierter Enzymimmobilisate für industriell relevante biokatalytische Reaktionen vorhersagbar zu machen.
Abb.1: Darstellung eines Enzym@MOF-Verbunds. Das Enzym ist in einer Einheit der Kristallstruktur immobilisiert.